今回はsp混成軌道!
今回も基礎中の基礎であるsp混成軌道というものについて話していくよ
大学でも先生に言われますが、この辺がわからなければこれからやっていけないとても大切な部分になっているから、しっかり勉強しておこう!
というか、数学でいう「かけ算と割り算は先に計算する」レベルのものだから、sp混成軌道なんて、最初はたまに間違えるけど、これから使いすぎて勝手に覚えてしまうようなものだからねw
けど、もしつまずいてしまったら留年確定なので気を引き締めて頑張りましょう。(ง •̀_•́)ง
共有結合
「おっと?いきなりsp混成軌道と関係ないのきたし、高校で習ったわー!」と思った方!優秀ですね~ 読み飛ばしてもらって構いません。
けど、「あれ。。。高校で習ったけどなんだったっけ?」という方は少し立ち止まって見ていくといいよ
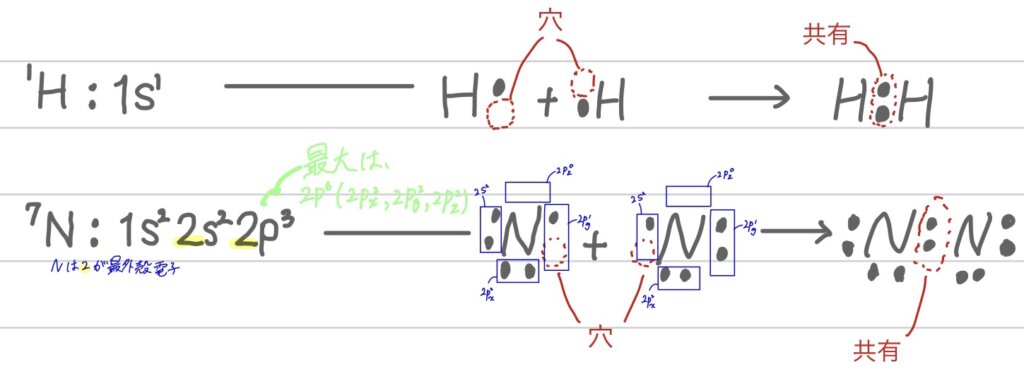
共有結合とは、上の図のように2つの原子の最外殻電子を共有して結合するというだけだね
まぁ一人では心に穴が開いてしまっているからほかの人で埋めることで安定するという感じだね
これで、次からの説明で共有結合という言葉を使っても平気だね
形式電荷


形式電荷とは、他の原子と結合していないときの原子の持つ価電子の数(上の画像の黄色マーカーの数字)と、結合しているときにその原子が所有している電子数(上の画像のピンクマーカーの数字)の差のことを言うんだ。
【読者の疑問】つまりどういう事?
つまり、上の画像の緑マーカーの部分のように、その分子中の特定原子(図1ではO酸素、図2ではN窒素)が,プラスorマイナスor中性なのかを判断する方法だよ
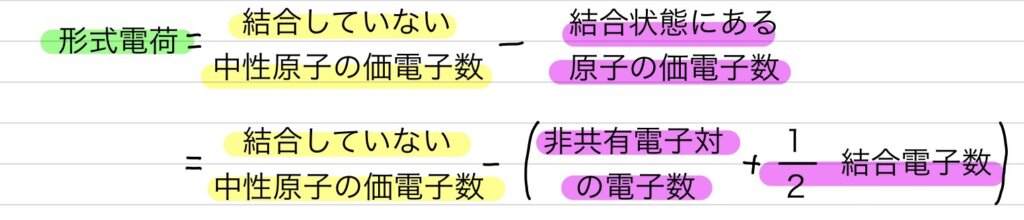
【形式電荷】=【結合していない中性原子の価電子数】-【結合状態にある原子の価電子数】
=【結合していない中性原子の価電子数】-(【非共有電子対の電子数】+【½結合電子数】)
という式で形式電荷を求めることが出来るよ。
少し慣れるまで練習は必要だけど、前期のテストまで覚えておけば何とかなるからそこまで力を入れなくても大丈夫だよ
sp混成軌道
ここでやっと本題!sp混成軌道!
sp混成軌道とはs軌道とp軌道が混ざって成り立っている軌道だよ
【読者の疑問】なんでわざわざ混ざるの?
それは、sp混成軌道じゃないと説明できないことが多々起こってしまうからなんだ。
では下の画像の C(炭素)を例に見てみよう
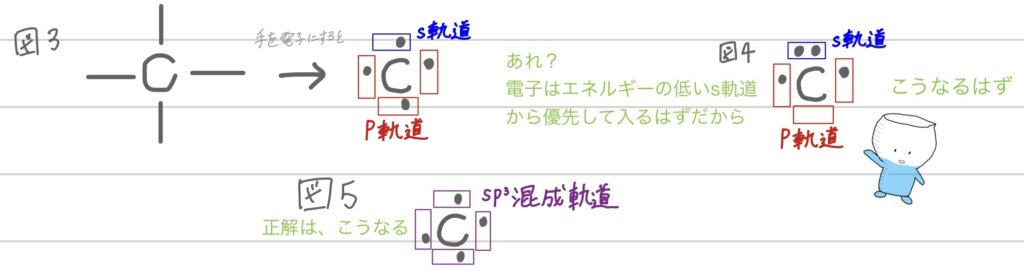
図3をみて、
あれ?電子はエネルギーの低いs軌道から優先して入るはずだから、図4のように、s軌道が2つと2つのpか軌道に1つづつの合計4つになるはず!
と思った人は、賢い!
ここで混成軌道!今回は、1つのs軌道と、3つのp軌道が混ざってsp³混成軌道ということになるよ。
ちなみに、1つのs軌道と、2つのp軌道が混ざってsp²混成軌道、1つのs軌道と、1つのp軌道が混ざってsp混成軌道と書くんだ。
sp混成軌道見分けるコツ
基本的には、単結合だとsp³混成軌道 2重結合だとsp²混成軌道 3重結合だとsp混成軌道って感じだよ
例外
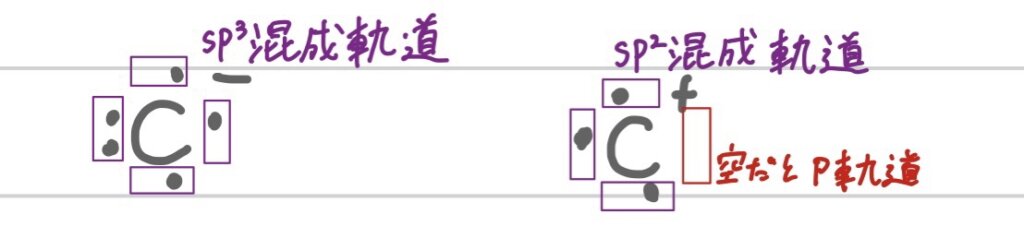
上で書いたコツには例外があるんだ。
上の画像のように電子を1つ失った状態(プラスに帯電した状態)だと、単結合でもsp²混成軌道になってしまうから課題などをやるときは注意しよう
さいごに
このような記事をこの「アスピリンブログ」では上げています。
他にも、現役薬学生ならではのエンタメ記事や自分が習ったこと、薬学に入りたい高校生に向けてのアドバイスなど薬学生のためのブログを書いています。
もしよかったら別の記事も見て行ってください(^o^)♪



コメント